|
Vaste problème ! Pour les plantes carnivores, il faut impérativement (sauf exception) une eau non calcaire, par exemple de l'eau de pluie et un substrat ("sol") formé de tourbe que l'on mélange habituellement avec un produit allégeant - perlite, vermicullite, voire polystyrène ! Le calcaire est une combinaison entre le gaz carbonique et un métal abondant, le calcium.
Il est attaqué par les acides organiques en redonnant du gaz carbonique et un sel de calcium.
Cette propriété est utilisé pour le détecter : quelques gouttes de vinaigre
produisent un dégagement de bulles. Les acides organiques de la tourbe peuvent donc aussi
se combiner avec ce calcaire. En libérant le gaz carbonique, elle perd en même temps
son acidité. Or, cette acidité la protégeait de la décomposition bactérienne
: la tourbe, formée pour l'essentiel de débris végétaux, se transforme alors en une matière putride,
onctueuse, asphyxiant les racines. Celles-ci ne sont pas adaptées à une acidité faible et cessent
de fonctionner, puis pourrissent à leur tour. L'eau de distribution est calcaire dans 90 % des cas même si vous n'êtes pas dans une région calcaire. On dit qu'elle est alcaline, c'est-à-dire qu'elle contient des sels solubles qui rendent le pH basique, le contraire d'acide. L'eau des puits l'est moins souvent, pour des raisons géologiques mais vous devez être sûr. Par exemple en Aquitaine, la couche supérieure est le plus souvent du sable perméable déposé au quaternaire suivi par de l'argile imperméable qui retient dans les sables encore au-dessus une nappe phréatique généralement acide. L'eau du robinet vient de forage plus profond, dans des nappes baignant "forcément" dans la couche calcaire du tertiaire. Le bassin parisien est analogue. L'eau de pluie ne peut pas être basique (pH > 7) mais plutôt acide à cause de la pollution ("pluies acides") mais pas seulement : la foudre combine l'azote et l'oxygène de l'air pour donner de l'oxyde d'azote qui se combine à l'eau pour faire de l'acide nitrique ! Si vous récupérez l'eau de pluie provenant d'un toit, il faut détourner une conduite d'écoulement des toits vers un réservoir en matériau inaltérable, en général du plastique. Pour une vingtaine d'euros, vous pouvez acheter des réservoirs de 300 L avec robinet ou sans. Pour le prix, vous avec un robinet parfaitement étanche fixé à l'intérieur par une vis foirée : en général, le robinet se barre en pleine utilisation... Mauvais souvenir... Depuis, il y a un bouchon placer de l'intérieur - depuis l'extérieur avec la pression cela peut sauter facilement. Méfiez vous tout de même de deux choses :- des restes d'un vieux mur battu par la pluie peuvent altérer votre eau. Regardez bien dans le récipient : il y a peut-être de
tous petits morceaux de pierre qui y sont tombés. Vérifiez avec un peu de vinaigre (apparition
de bulles à froid). De petits morceaux de même couleur au pied du mur, au sol ou dans des pots peuvent aussi être des indices. L'eau de Volvic est souvent citée
mais c'est tout à fait injustifié : son pH est de 7, c'est à dire celui d'une eau normale. En cherchant
un peu dans un supermarché il est possible de trouver une eau de source acide (c'est-à-dire
d'un pH en dessous de 7). L'eau déminéralisée est aussi une solution acceptable pour une collection modeste en milieu clos. (En plein air l'évaporation est trop élevée.) Son prix a beaucoup baissé maintenant et on peut la trouver à des prix inférieurs à celui de l'eau de source, pourquoi sans priver. L'eau osmosée produite par un petit osmoseur sera une solution intéressante pour une collection importante : on en trouve actuellement
(2005) aux alentours de 100 € en magasins d'aquariophilie et sur Internet. Mais il faut savoir que ce procédé n'a pas un rendement très élevé : seulement
10% d'eau pure sera extraite et le reste sera perdu si on ne peut l'utiliser
(usages domestiques, jardin)... Cette technique peut donc aller à l'encontre de la protection
de l'environnement à laquelle les amateurs de plantes carnivores sont souvent sensibilisés. Un gros producteur de plantes carnivores exclusivement devra jeter cette eau. Toutefois il y a des
exceptions : l'eau calcaire et même l'engrais peuvent être utilisés avec les Népenthes, Marthyniacées, quelques Grassettes... La tourbe ne leur est pas indispensable et en son absence absolue, l'utilisation
d'une eau ordinaire est possible. Certaines grassettes sont indifférentes, d'autres préfèrent même
des substrats calcaires et d'autres encore des terrains dolomitiques (comme une excursion au Cirque
de Gavarnie nous l'a montré). La dolomite est riche en magnésium. "pH" signifie "potentiel Hydrogène" car il correspond au potentiel en ions hydrogène que possède un liquide. Pour comprendre l'intérêt de cette notion, il faut connaître quelques bases de chimie. L'hydrogène (H) est l'élément le plus simple de l'Univers, avec un seul électron et un seul proton (accompagné parfois d'un ou deux neutrons). Si l'atome perd cet unique électron, il ne reste plus qu'un proton, une particule élémentaire infiniment petite, chargé positivement du point de vue électrique, qui ne peut pas ainsi restée libre dans l'eau. Ce proton va donc se fixer sur la première molécule d'eau venue, H2O. C'est un proton mais chimiquement on rappellera que cela devient de l'hydrogène par simple ajout d'un électron : en chimie on écrira donc H+. Ce qui donne : H2O + H+<=> H3O+ C'est pour cela que pour simplifier l'écriture je parle de préférence de H+ plutôt que de H3O+. C'est entièrement volontaire ;-) Sans ajout d'acide ou de base, chaque molécule d'eau peut subir spontanément la réaction suivante, qui s'appelle l'ionisation de l'eau, puisqu'elle produit deux ions très importants : H2O <=> H+ + OH- On voit qu'il y a autant d'un ion que de l'autre. On dira que l'eau est neutre. Dans les conditions standards (20° C, etc.) la quantité de molécules d'eau ainsi ionisées est très précise : 1 sur 10 000 000, soit 1/107 ou encore 10-7. Ceci est essentiel parce que le pH est exactement le nombre qui est ainsi en exposant, le 7 dans ce cas. (En math, on appelle cela le logaritme mais ce n'est pas nécessaire de le savoir.) Donc, pH 5 correspond à une eau avec 1 ion H3O+ pour 105 soit 100 000 molécules d'eau (1/100 000 = c'est-à-dire 100 fois plus que précédemment, la normale. Une telle eau, nettement plus acide que l'eau neutre, est habituelle dans une tourbière. Il suffit qu'elle est à peine plus d'ion H3O+ que la normale pour qu'une eau soit dite acide et on voit que cela correspond à un pH inférieur à 7. Symétriquement, avec moins d'ions H3O+ l'eau est dite alcaline. Les plantes carnivores vivent entre certaines valeurs, variables selon l'espèce, de pH 3.5 à 8. A remarquer que les termes géologiques de roches basiques ou acides ne recouvrent pas exactement la même notion : une roche est dite acide quand elle est très riche en silice, substance pratiquement insoluble qui n'agit donc pas sur l'eau. Pour info, alcalin et basique ne sont pas exactement synonymes. Il faut qu'une substance soit soluble pour être alcaline : la soude, le bicarbonate de soude, le savon de Marseille sont alcalins. Un morceau de calcaire, de la rouille, du vert-de-gris sont basique parce que chimiquement ils vont se comporter comme une base lorsqu'on les plonge dans un acide, mais ils ne sont pas alcalins parce qu'il ne sont pas solubles (infiniment peu). La mesure du pH se fait à 20°C par convention (norme). ÉlectriquementDeux électrodes trempent dans le liquide, éventuellement dans le substrat très humide. Les ions hydrogènes modifient le potentiel électrique de manière différente pour les deux électrodes (de composition différente) et la différence de potentiel est ce que l'on appelle couramment, si j'ose dire :-) la tension d'un courant. Ce courant est traité de manière à pouvoir déplacer une aiguille ou modifier un affichage digital. L'ensemble forme un ph-mètre. Des électrodes fiables sont très coûteuses (elles sont enveloppées par une paroi de verre poreux qui ne laissent passer que certains ions : pas évident à fabriquer...) et un appareil précis coûte de l'ordre de 150 €. Il existe un appareil que l'on plante dans le sol et dont on peut tremper la pointe bimétallique également dans les liquides ou le sol. Les métaux ressemblent à de l'aluminium et sont facilement oxydables ce qui oblige à un décapage systématiquement à chaque trempage. Cet appareil, de l'ordre de 9 €, est absolument fantaisiste et n'est qu'un gadget que je vous déconseille formellement car il entraîne de graves erreurs. ChimiquementIl s'agit de provoquer un changement dans un (en pratique plusieurs)
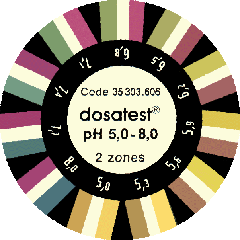
équilibre chimique. Cette technique par colorants est moins précise mais on arrive tout de même à une précision 0.3 et même un peu moins car on peut observer des nuances intermédiaires. Ils ont l'inconvénient de ne se conserver que quelques mois. Vous avez intérêt à les conserver au froid et au sec. Vous devez pouvoir contrôler si vos produits ne sont pas périmés en utilisant une eau de source de pH indiqué sur la bouteille, ou encore une solution connue (éventuellement préparée lorsque les produits venaient d'être achetées...) L'eau qui se condense sous une assiette placée au dessus d'une eau bouillante de robinet devrait être neutre ou un peu acide (co2), mais pas basique (pH > 7). Deux présentations : - liquide, très souvent vendu dans les magasins d'aquariophilie. Utilisation simple mais une zone de pH concerné qui ne correspond pas exactement à celle des plantes carnivores.
Maintenez la bandelette quelques secondes dans l'eau avant de la retirer et attendre la stabilisation des colorants (une bonne minute). La conservation ne dépasse pas un an, mais vous pouvez espérer bien plus, comme pour les graines, en rusant un peu. Truc perso :
Où peut-on obtenir le pH de l'eau du robinet ? L'eau de distribution est parfaitement connue par votre distributeur qui pourra vous renseigner mais il est rare en France que cette eau soit non calcaire pour des raisons géologiques. Beaucoup de régions sont sédimentaires, avec des alternances de sables et de calcaires et quelquefois une couche argileuse qui la retient. L'eau distribuée provient souvent de couches profondes et il y a de fortes chances qu'elle en est traversé avec au moins des traces de calcaire. L'eau des puits est souvent moins profonde (elle ne vient que de la première nappe d'eau rencontrée, dite phréatique) et il arrive ainsi qu'elle soit même acide. Beaucoup de villes sont construites sur d'anciennes régions marécageuses asséchées, en fait d'anciennes tourbières, et les quelques mètres traversés par l'eau suffisent à l'acidifier. SI vous n'avez pas de puit et pour information, voici tout de même une carte de France qui vous donnera une idée de la teneur en calcaire de votre eau du robinet (titre hydrotimétrique). Tenez compte du fait que cette valeur est arrondie par département : dans des localités limitrophes cela peut ne pas correspondre du tout.
J'ai mesuré le pH de l'eau il y a quelques heures et je n'obtiens pas le même résultat. Pourquoi et lequel retenir ? Le pH de l'eau varie en permanence pendant la journée. Cela est dû notamment à la teneur en gaz carbonique CO2 qui est libéré par les animaux et aussi, la nuit, par les plantes, qui consomment alors les sucres qu'elles ont produits grâce à l'énergie solaire et au... gaz carbonique pris dans le milieu ! De ce fait, la lumière et la présence de nombreuses plantes provoquent une absorption du gaz carbonique, acidifiant bien connu de l'eau gazeuse. L'acidité va donc diminuer, ce qui se mesure par un pH plus faible. L'obscurité provoque donc une libération de CO2 par les plantes et une acidification de l'eau. Il faut donc mesurer le pH à la même heure (en fait après une
durée d'éclairement équivalent). Vous utiliserez celui qui vous intéresse en fonction de ce qui
vient d'être dit. L'amplitude peut aussi être un paramètre intéressant à étudier... Comment savoir si ma mesure est fiable ? J'obtiens des résultats inattendus... - Vous mesurez le pH d'une eau de pluie est vous obtenez plus de 7 ? Explications possibles :
- Vous mesurez le pH d'une eau de source qui vous a été conseillée, comme celle de la marque Cristalline et vous constatez un pH 7.5. Pour l'anecdote, j'ai reçu un mail de quelqu'un qui affirmait,que malgré "un vrai site style scientifique" je n'étais pas sérieux parce que j'indiquais ici que l'eau Cristalline était à pH 4.5, même que "je te dis pas la défenestration de foie" ;-). Il n'avait pas lu le début de cette page où j'indiquais que Cristalline était une marque, qu'à Strasbourg elle est à pH 4.5 mais qu'à Bordeaux elle est alcaline ! Pour info, un tel pH est inoffensif car la paroi de l'estomac lui-même est proche de pH 2 ! Vous pouvez contrôler la qualité de votre mesure en la testant avec une eau de source car son pH est certain, régulièrement contrôlé et on ne peut plus stable en composition. Essayez éventuellement avec de la glace du freezer (la plus propre possible), une fois ramenée à température ambiante, 20° normalement - cela joue dans la réaction. Cette eau ne peut ABSOLUMENT PAS être basique. Même remarque en récupérant de l'eau de condensation sur une assiette retournée au dessus d'eau bouillante, sauf dans la période où elle laisse s'échapper ses gaz, au début de l'ébullition. Dès l'achat vous pouvez faire un test voire même réaliser une solution acide stable (de préférence avec des acides non volatiles comme les acides sulfurique, phosphorique) qui servira de référence plus tard, pour voir si votre produit est encore bon... Lorsqu'il s'agit de plantes aquatiques, il suffit généralement
de faire une infusion de tourbe, si possible en la faisant bouillir, ce qui peut tuer les germes
de moisissures, assure une dissolution rapide et intense des acides humiques et facilite la combinaison
chimique entre ceux-ci et les sels dissous (ions Ca++ notamment). Souvenez-vous que, théoriquement, lorsque vous mélangez des
eaux de pH différents, c'est l'eau acide qui domine. En effet, si vous coupez un litre d'une eau
à pH 4 avec autant d'une eau à pH 7, la première apporte 10-4 ions H3O+ (ou H+,
si vous préférez...), alors que la seconde n'en apportera que 10-7, soit MILLE fois moins,
ce qui est négligeable par rapport à l'autre. Vous voyez que l'on se trouve donc maintenant avec les 10-4 ions H3O+ dilués
dans deux fois plus d'eau. (C'est là qu'il faut connaître les logaritmes pour calculer le pH obtenu) Ces considérations sont THÉORIQUES. En effet : En PRATIQUE, l'infusion de tourbe est un puissant acidifiant pour nos plantes, mais il en faudra nettement plus pour compenser des eaux calcaires. Remarque : cette tourbe bouillie, plus ou
moins stérile, est tout à fait réutilisable, sauf si l'eau initiale était calcaire (mais rien ne
vous empêche de recommencer avec l'eau obtenue, acide, et de la tourbe fraîche). |